IRB
국립정신건강센터 임상시험심사위원회(Institutional Review Board, IRB)에서는 연구계획서 또는 변경계획서, 기타 보고 등 연구대상자에게 사용하는 방법이나 제공되는 정보를 검토하고 지속적으로 이를 확인함으로써 임상시험 또는 연구에 참여하는 연구대상자의 권리, 안전, 복지를 보호하기 위해 노력하고 있습니다.
연구계획서의 윤리적ㆍ과학적 타당성을 심의하여 심의 및 승인 여부 결정, 연구자 및 종사자 교육, 취약한 연구대상자등의 보호 대책 수립, 연구자를 위한 윤리지침 마련 등의 역할을 담당하고 있습니다.
심의 절차
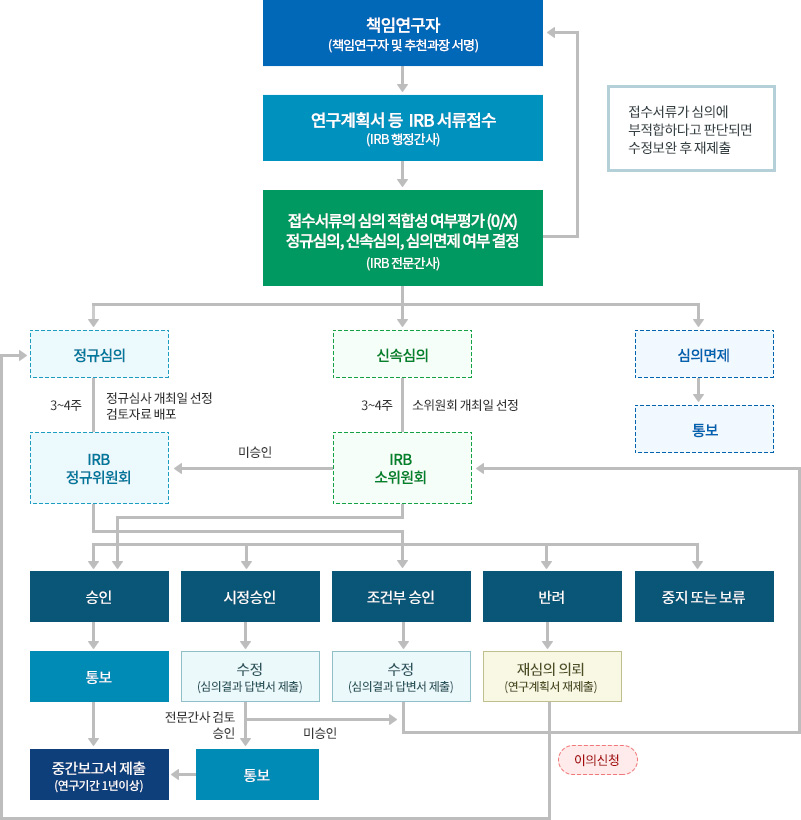
심의 절차
- 책임연구자(책임연구자 및 추천과장 서명)
- 연구계획서 등 IRB 서류접수(IRB 행정간사)
- 접수서류의 심의 적합성 여부평가 (0/X) 정규심의, 신속심의, 심의면제 여부 결정(IRB 전문간사)
- 접수서류가 심의에 부적합하다고 판단되면 수정보완 후 재제출
-
- 정규심의 (3~4주, 정규심사 개최일 선정 검토자료배포)
- IRB 정규위원회
- 승인 → 통보 → 중간보고서 제출 (연구기간1년이상)
- 시정승인 → 수정(심의결과 답변서 제출) → 전문간사 검토 승인 → 통보 또는 시정승인 → 수정(심의결과 답변서 제출) → 전문간사 검토 미승인 → IRB 소위원회
- 조건부승인 → 수정(심의결과 답변서 제출) → IRB 소위원회
- 반려 → 재심사의뢰(연구계획서 재제출) → 이의신청 → 정규심의
- 중지 또는 보류
- IRB 정규위원회
- 신속심의 (3~4주, 소위원회 개최일 선정)
-
- IRB 소위원회
- 승인
- 통보
- 중간보고서 제출(연구기간 1년이상)
- 미승인
- IRB 정규위원회
- 조건부 승인
- 수정(심의결과 답변서 제출)
- IRB 소위원회
-
- 심의면제 → 통보
- 정규심의 (3~4주, 정규심사 개최일 선정 검토자료배포)
 이 누리집은 대한민국 공식 전자정부 누리집입니다.
이 누리집은 대한민국 공식 전자정부 누리집입니다.